Отдавна е известно, че всички молекули притежават два еднакви и противоположни заряда, които са разделени на определено разстояние. В случай на такива полярни молекули центърът на отрицателния заряд не съвпада с центъра на положителния заряд. Степента на полярност в такива ковалентни молекули може да бъде описана с термина Диполен момент, който по същество е мярката на полярността в полярна ковалентна връзка.
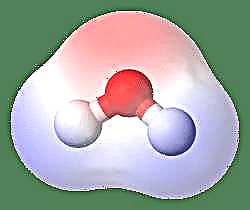
Най-простият пример за дипол е водна молекула. Молекулата на водата е полярна поради неравномерното споделяне на нейните електрони в „огъната“ структура. Водната молекула образува ъгъл с водородни атоми в върховете и кислород в върха. Тъй като кислородът има по-висока електроотрицателност от водорода, страната на молекулата с кислородния атом има частичен отрицателен заряд, докато водородът в центъра има частичен положителен заряд. Поради това посоката на диполния момент сочи към кислорода.
На езика на физиката, електричният диполен момент е мярка за разделянето на положителните и отрицателните електрически заряди в система от заряди, тоест мярка за общата полярност на системата за зареждане - т.е. разделянето на електрическия заряд на молекулите, който води до дипол. Математически и в простия случай на две точкови заряди, един със заряд + q и един със заряд? Q, електрическият диполен момент p може да се изрази като: p = qd, където d е векторът на изместване, сочещ от отрицателния заряд към положителният заряд. По този начин, векторът на електрическия диполен момент p сочи от отрицателния заряд към положителния заряд.
Друг начин да се погледне е да се представи Диполният момент с гръцката буква m, m = ed, където e е електрическият заряд и d е разстоянието на разделяне. Тя се изразява в единиците на Debye и се записва като D (където 1 Debye = 1 x 10-18e.s.u cm). Диполният момент е векторно количество и затова е представен от малка стрелка с опашка в положителния център и глава, насочена към отрицателен център. В случая на молекула на водата моментът на Дипола е 1,85 D, докато молекулата на солна киселина е 1,03 D и може да бъде представена като:
Написахме много статии за диполен момент за сп. „Спейс“. Ето статия за това от какво се прави вода и ето тази статия за молекулите.
Ако искате повече информация за диполния момент, разгледайте тези статии от Hyperphysics and Science Daily.
Записахме и цял епизод от Астрономически роли за молекулите в Космоса. Чуйте тук, Епизод 116: Молекули в Космоса.
Източници:
http://en.wikipedia.org/wiki/Electric_dipole_moment
http://en.wikipedia.org/wiki/Dipole
http://www.tutorvista.com/content/chemistry/chemistry-iii/chemical-bonding/degree-polarity.php
http://hyperphysics.phy-astr.gsu.edu/hbase/electric/dipole.html#c1
http://en.wikipedia.org/wiki/Water_molecule