Атомната теория измина дълъг път през последните няколко хиляди години. Започвайки през V в. Пр. Н. Е. С теорията на Демокрит за неделимите „корпускули”, които взаимодействат помежду си механично, след това преминават върху атомния модел на Далтън през 18 век и след това отлежават през 20 век с откриването на субатомни частици и квантова теория, пътуването на откриването е било дълго и криволичещо.
Вероятно, един от най-важните етапи по пътя е атомният модел на Бор, който понякога е наричан атомния модел на Ръдърфорд-Бор. Предложен от датския физик Нилс Бор през 1913 г., този модел изобразява атома като малко, положително заредено ядро, заобиколено от електрони, които се движат по кръгови орбити (определени от техните енергийни нива) около центъра.
Атомната теория към 19 век:
Най-ранните известни примери на атомната теория идват от древна Гърция и Индия, където философи като Демокрит постулират, че цялата материя е съставена от малки, неделими и неразрушими единици. Терминът "атом" е въведен в древна Гърция и е създал училището на мисълта, известно като "атомизъм". Тази теория обаче беше по-скоро философска концепция, отколкото научна.
Едва през 19 век теорията на атомите се артикулира като научна материя, като се провеждат първите експерименти, основани на доказателства. Например, в началото на 1800 г. английският учен Джон Далтън използва концепцията за атома, за да обясни защо химическите елементи реагират по определени наблюдаеми и предвидими начини. Чрез поредица от експерименти с газове, Далтън продължи да разработва това, което е известно като атомната теория на Далтън.
Тази теория се разшири по законите на разговор на маса и определени пропорции и се сведе до пет предпоставки: елементи, в най-чистото си състояние, се състоят от частици, наречени атоми; атомите на конкретен елемент са еднакви, чак до последния атом; атомите на различни елементи могат да бъдат разграничени от техните атомни тегла; атомите на елементите се обединяват и образуват химични съединения; атомите не могат да бъдат създадени или унищожени при химическа реакция, само групирането се променя.
Откриване на електрона:
В края на 19 век учените също започват да теоретизират, че атомът е съставен от повече от една основна единица. Повечето учени обаче се осмелиха, че тази единица ще бъде с размерите на най-малкия известен атом - водород. В края на 19 век това ще се промени драстично благодарение на изследвания, проведени от учени като сър Джоузеф Джон Томсън.
Чрез поредица от експерименти, използващи катодни тръби (известни като тръба на Крукс), Томсън забелязва, че катодните лъчи могат да бъдат отклонени от електрически и магнитни полета. Той заключи, че вместо да са съставени от светлина, те са съставени от отрицателно заредени частици, които са 1ooo пъти по-малки и 1800 пъти по-леки от водорода.

Това ефективно опроверга идеята, че водородният атом е най-малката единица на материята и Томпсън продължи да предполага, че атомите са неделими. За да обясни общия заряд на атома, който се състои както от положителни, така и от отрицателни заряди, Томпсън предлага модел, при който отрицателно заредените „корпускули“ се разпределят в еднородно море с положителен заряд - известен като Plum Pudding Model.
По-късно тези корпускули ще бъдат наречени „електрони“, базирани на теоретичната частица, предсказана от англо-ирландския физик Джордж Джонстоун Стоуни през 1874 г. И от това се роди Моделът на пудинг от сливи, наречен така, защото много прилича на английската пустиня, която се състои от сливова торта и стафиди. Концепцията е представена на света през март 1904 г. изданието на Великобритания Философско списание, да приветствам широко.
Моделът на Ръдърфорд:
Последвалите експерименти разкриха редица научни проблеми с модела Plum Pudding. За начало имаше проблем с демонстрирането, че атомът притежава равномерен положителен заряд, който стана известен като „Проблемът на Томсън“. Пет години по-късно моделът ще бъде опроверган от Ханс Гейгер и Ърнест Марсдън, които проведоха поредица от експерименти, използвайки алфа-частици и златно фолио - ака. експериментът със златно фолио.
В този експеримент Гейгер и Марсдън измерват схемата на разсейване на алфа частиците с флуоресцентен екран. Ако моделът на Томсън беше правилен, алфа частиците щяха да преминават през атомната структура на фолиото безпрепятствено. Въпреки това те отбелязаха, че докато повечето стреляха направо, някои от тях бяха разпръснати в различни посоки, а някои се върнаха обратно в посока на източника.

Гайгер и Марсдън заключиха, че частиците са срещнали електростатична сила, много по-голяма от разрешената от модела на Томсън. Тъй като алфа частиците са просто хелиеви ядра (които са положително заредени), това означава, че положителният заряд в атома не е широко диспергиран, а концентриран в малък обем. Освен това фактът, че тези частици, които не са били отклонени, преминават през безпрепятствено, означава, че тези положителни пространства са разделени от огромни заливи от празно пространство.
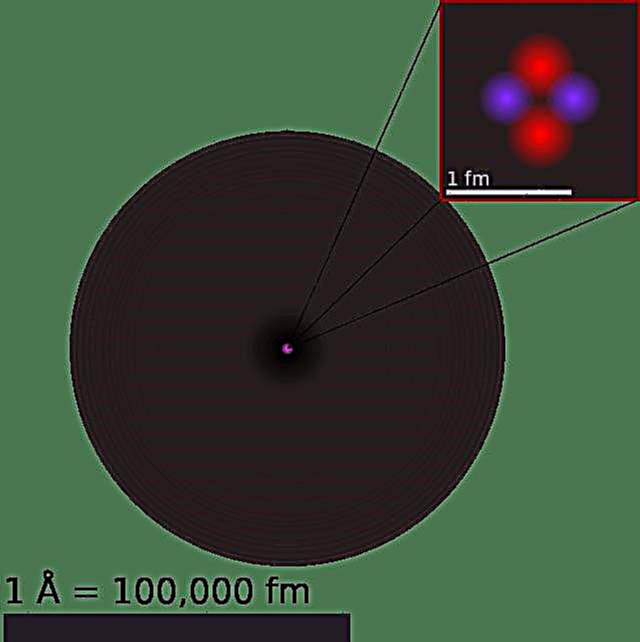
До 1911 г. физикът Ърнест Ръдърфорд интерпретира експериментите на Гейгер-Марсден и отхвърля модела на Томсън на атома. Вместо това той предложи модел, при който атомът се състои предимно от празно пространство, като целият му положителен заряд се концентрира в центъра му в много малък обем, който беше заобиколен от облак от електрони. Това стана известно като моделът на Ръдърфорд на атома.
Моделът Бор:
Последвалите експерименти на Антоний Ван ден Брук и Нилс Бор усъвършенстват модела допълнително. Докато Ван ден Брук предположи, че атомният номер на даден елемент е много подобен на ядрения му заряд, последният предложи модел на атома, подобен на Слънчевата система, където ядрото съдържа атомния брой на положителен заряд и е заобиколено от равно брой електрони в орбитални обвивки (известен още като модел на Бор).
В допълнение, моделът на Бор усъвършенства някои елементи от модела на Ръдърфорд, които бяха проблематични. Те включват проблемите, произтичащи от класическата механика, която предвиждаше, че електроните ще отделят електромагнитно излъчване, докато орбитират в ядро. Поради загубата на енергия, електронът би трябвало бързо да се извие навътре и да се срине в ядрото. Накратко, този атомен модел предполага, че всички атоми са нестабилни.

Моделът също така предвиждаше, че когато електроните се спирали навътре, излъчването им бързо ще се увеличава по честота, тъй като орбитата става по-малка и по-бърза. Обаче експериментите с електрически разряди в края на 19 век показват, че атомите излъчват електромагнитна енергия само при определени дискретни честоти.
Бор реши това, като предложи електроните да обикалят около ядрото по начини, които са в съответствие с квантовата теория на радиацията на Планк. В този модел електроните могат да заемат само определени разрешени орбитали с определена енергия. Освен това те могат да спечелят и губят енергия само като скачат от една разрешена орбита на друга, поглъщайки или излъчвайки електромагнитно излъчване в процеса.
Тези орбити бяха свързани с определени енергии, които той посочи като енергийни черупки или нива на енергия, С други думи, енергията на електрон в атома не е непрекъсната, а се „квантира“. По този начин тези нива са етикетирани с квантовото число н (n = 1, 2, 3 и т.н.), която той твърди, че може да бъде определена по формулата на Райберг - правило, формулирано през 1888 г. от шведския физик Йоханес Риберг, за да опише дължините на вълните на спектрални линии на много химични елементи.
Влияние на модела на Бор:
Докато моделът на Бор в някои отношения се оказа революционен - сливането на константата на Риберг и константата на Планк (известна още като квантова теория) с модела на Ръдърфорд - той страдаше от някои недостатъци, които по-късните експерименти биха илюстрирали. Като начало се предполагаше, че електроните имат както известен радиус, така и орбита, нещо, което Вернер Хайзенберг би опровергал десетилетие по-късно със своя Принцип на несигурност.
Освен това, макар да беше полезен за прогнозиране на поведението на електроните във водородните атоми, моделът на Бор не беше особено полезен при прогнозиране на спектрите на по-големите атоми. В тези случаи, когато атомите имат множество електрони, енергийните нива не съответстват на предсказаното от Бор. Моделът също не работи с неутрални хелиеви атоми.
Моделът Бор също не би могъл да обясни ефекта на Земан, явление, отбелязано от нидерландските физици Питер Земан през 1902 г., при което спектралните линии са разделени на две или повече в присъствието на външно, статично магнитно поле. Поради това бяха направени опити за няколко уточнения с атомния модел на Бор, но те също се оказаха проблематични.
В крайна сметка това ще доведе до заместване на модела на Бор от квантовата теория - в съответствие с работата на Хайзенберг и Ервин Шрьодингер. Въпреки това, моделът на Бор остава полезен като инструктивен инструмент за запознаване на студентите с по-модерни теории - като квантова механика и атомен модел на валентната обвивка.
Това също ще се окаже основен момент в разработването на Стандартния модел на физика на частиците, модел, характеризиращ се с „електронни облаци“, елементарни частици и несигурност.
Тук сме писали много интересни статии за атомната теория в Space Magazine. Ето атомния модел на Джон Далтън, какво представлява моделът на пудинг от сливи, какъв е моделът на електронния облак? Кой беше Демокрит? И какви са частите на атома?
Astronomy Cast също има някои епизоди по темата: Епизод 138: Квантова механика, Епизод 139: Енергийни нива и спектри, Епизод 378: Ръдърфорд и атоми и Епизод 392: Стандартният модел - Intro.
Източници:
- Нилс Бор (1913) „За Конституцията на атомите и молекулите, част I“
- Нилс Бор (1913) „За Конституцията на атомите и молекулите, част II Системи, съдържащи само един нуклеус“
- Енциклопедия Британика: Атомен модел на Бор
- Хиперфизика - модел на Бор
- Университет на Тенеси, Ноксвил - Моделът Бор
- Университет на Торонто - Борският модел на Атома
- НАСА - Представете си Вселената - Фон: Атоми и светлинна енергия
- Относно образованието - Bohr Model of the Atom